Um laboratorista precisa
preparar 1,1 kg de solução aquosa saturada de um sal de dissolução
exotérmica, utilizando como soluto um dos três sais disponíveis em seu
laboratório: X, Y e Z. A temperatura final da solução deverá ser igual a
20 ºC.
Observe as curvas de solubilidade dos sais, em gramas de soluto por 100 g de água:
Observe as curvas de solubilidade dos sais, em gramas de soluto por 100 g de água:
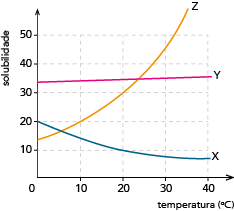
A massa de soluto necessária, em gramas, para o preparo da solução equivale a:
(A) 100
(B) 110
(C) 300
(D) 330
Alternativa correta: (A)
Eixo interdisciplinar: As substâncias e suas transformações
Item do programa: Fenômenos térmicos
Subitem do programa: Termoquímica
Item do programa 2: Soluções
Subitem do programa 2: Unidades de concentração expressas em percentagem, em g.L-1 e em quantidade de matéria
Objetivo: Calcular a massa de soluto necessária para o preparo de uma solução aquosa.
Comentário da questão:
A dissolução de um sal genérico AnBm pode ser representada pela seguinte equação química:
AnBm (s)  n A+m (aq) + m B-n (aq)
n A+m (aq) + m B-n (aq)
 n A+m (aq) + m B-n (aq)
n A+m (aq) + m B-n (aq)
A dissolução em análise é
um processo exotérmico, ou seja, há liberação de energia. O aumento da
temperatura favorece as reações endotérmicas, isto é, aquelas em que há
absorção de energia. Logo, um sal com dissolução exotérmica terá sua
solubilidade reduzida com o aumento da temperatura.
Dentre os três sais disponíveis, o que apresenta dissolução exotérmica está representado pela curva X. De acordo com essa curva, a 20 ºC, a solubilidade é igual a 10 g de sal por 100 g de água.
Misturando-se 10 g de sal com 100 g de água, obtêm-se 110 g de solução.
Se 10 g de sal correspondem a 110 g de solução, para o preparo de 1,1 kg de solução, tem-se:
Dentre os três sais disponíveis, o que apresenta dissolução exotérmica está representado pela curva X. De acordo com essa curva, a 20 ºC, a solubilidade é igual a 10 g de sal por 100 g de água.
Misturando-se 10 g de sal com 100 g de água, obtêm-se 110 g de solução.
Se 10 g de sal correspondem a 110 g de solução, para o preparo de 1,1 kg de solução, tem-se:
10 g 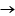 110 g
110 g
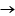 110 g
110 g
M 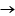 1100 g M = 100 g
1100 g M = 100 g
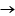 1100 g M = 100 g
1100 g M = 100 gPercentual de acertos: 21,48%
Nível de dificuldade: Difícil (abaixo de 30%)
Fonte: http://www.revista.vestibular.uerj.br
Nenhum comentário:
Postar um comentário