UERJ Vestibular 2014 - Exame Discursivo de Química - Questão 3 comentada.
O enxofre é um elemento químico que pode formar dois óxidos moleculares: SO2 e SO3.
Nomeie a geometria dessas moléculas. Explique, ainda, por que apenas o SO2 é solúvel em água.
Objetivo: Nomear a geometria de moléculas e explicar a diferença entre elas quanto à solubilidade em água.
Item do programa: Ligações interatômicasSubitem do programa: Covalentes
Item do programa: Ligações interatômicasSubitem do programa: Covalentes
Item do programa 2: Moléculas
Subitem do programa: Geometria
Subitem do programa: Propriedades físicas
Comentário da questão:
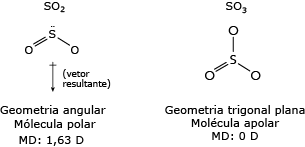
No SO2, o átomo de enxofre forma uma ligação dupla com um dos átomos de oxigênio, e um dos seus pares de elétrons livres forma uma ligação covalente dativa com o outro átomo de oxigênio.
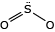
Portanto, o átomo de enxofre permanece com um par de elétrons livres que repele os elétrons das ligações covalentes, deslocando as ligações químicas desse átomo para baixo, fazendo com que a geometria dessa molécula seja angular e não linear. Ao avaliar a polaridade das ligações químicas dessa substância, verifica-se que, no somatório de forças vetoriais, há um vetor resultante na direção dos átomos de oxigênio, que são mais eletronegativos que o átomo de enxofre, fazendo com que essa molécula tenha um momento dipolo (MD) de 1,63 D (debay). Logo, o SO2 é uma molécula polar.

Portanto, o átomo de enxofre permanece com um par de elétrons livres que repele os elétrons das ligações covalentes, deslocando as ligações químicas desse átomo para baixo, fazendo com que a geometria dessa molécula seja angular e não linear. Ao avaliar a polaridade das ligações químicas dessa substância, verifica-se que, no somatório de forças vetoriais, há um vetor resultante na direção dos átomos de oxigênio, que são mais eletronegativos que o átomo de enxofre, fazendo com que essa molécula tenha um momento dipolo (MD) de 1,63 D (debay). Logo, o SO2 é uma molécula polar.
No SO3, o segundo par de elétrons livres do átomo de enxofre faz uma ligação covalente dativa com o terceiro átomo de oxigênio, conferindo a essa molécula uma geometria trigonal plana.
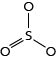
Devido a essa geometria, o SO3 não apresenta um vetor resultante, já que o átomo de enxofre está rodeado por três átomos de oxigênio. Logo, o momento dipolo dessa molécula é igual a zero, o que lhe confere um caráter apolar.
A água é um solvente polar e, de acordo com a regra de afinidade química, solutos polares são solúveis em solventes polares. O SO2 é polar, logo solúvel em água; o SO3 é apolar, logo insolúvel em água.

Devido a essa geometria, o SO3 não apresenta um vetor resultante, já que o átomo de enxofre está rodeado por três átomos de oxigênio. Logo, o momento dipolo dessa molécula é igual a zero, o que lhe confere um caráter apolar.
A água é um solvente polar e, de acordo com a regra de afinidade química, solutos polares são solúveis em solventes polares. O SO2 é polar, logo solúvel em água; o SO3 é apolar, logo insolúvel em água.
Observação:
A representação clássica da ligação dativa é por uma seta. Entretanto, a recomendação mais recente é de representá-la por uma ligação simples, tal qual a ligação covalente simples. Assim, são aceitas as seguintes fórmulas estruturais:
Para o SO2:
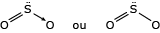
Para o SO3:
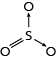 ou
ou
Nenhum comentário:
Postar um comentário